پیشگفتار:
پیش از پاسخ به سوال الکترولیت چیست باید اشاره کنم که پیشتر در بخشی از نوشته نیمههادی چیست و علت اهمیت آن در الکترونیک بیان شد که حاملهای بار الکتریکی (Charge Carriers) به ذره یا شبهذرهای گفته میشود که آزادانه حرکت میکند و حامل بار الکتریکی است! نمونههای حاملان بار عبارتند از: الکترونها، یونها و حفرهها. شاید در مطالعات شخصی خود با جریان الکتریکیای که حاملان بار در آن الکترونها باشند یا جریان الکتریکیای که حاملان بار در آن حفرهها باشند برخورد کرده باشید. در این مطلب میخواهیم با شرایطی که حاملان بار در جریان الکتریکی یونها هستند مواجه شویم، پس با ما همراه باشید.
الکترولیت چیست؟
الکترولیت مادهای است که الکتریسیته را از طریق حرکت یونها هدایت میکند، و نه از طریق حرکت الکترونها (الکترونهای تنها (lone electrons) معمولا نمیتوانند از آن عبور کنند). نمونههایی از الکترولیتها شامل اکثر نمکها، اسیدها و بازهای محلول است، در واقع در یک حلال مانند آب حل شدهاند. پس از حل شدن، این ماده به کاتیونها (یونهای مثبت) و آنیونها (یونهای منفی) تقسیم میشود که بهطور یکنواخت در سراسر حلال پراکنده میشوند. الکترولیتهای حالت جامد نیز وجود دارند. توجه شود که در پزشکی و گاهی در شیمی، اصطلاح الکترولیت به مادهای اطلاق میشود که حل میشود.
از نظر الکتریکی، چنین محلولی (بهعنوان مثال نمک حلشده در آب) خنثی است. اگر پتانسیل الکتریکی (طبیعتا از طریق منبع تغذیه) به چنین محلولی اعمال شود، کاتیونهای محلول به سمت الکترودی که دارای الکترون فراوان است کشیده میشوند، در حالی که آنیونها به سمت الکترودی که دارای کمبود الکترون است. حرکت آنیونها و کاتیونها در جهات مخالف در داخل محلول برابر با جریان است.
برخی از گازها، مانند کلرید هیدروژن (HCL)، تحت شرایط دمای بالا یا فشار کم نیز میتوانند بهعنوان الکترولیت عمل کنند (لذا الکترولیت صرفا محدود به حالت مایع نیست). بنابراین متوجه شدیم که مادهای که در محلول یا در صورت ذوب کردن آن (تبدیل آن از جامد به مایع با استفاده از حرارت) به یون تجزیه میشود، ظرفیت رسانایی الکتریسیته را به دست میآورد. سدیم، پتاسیم، کلرید، کلسیم، منیزیم و فسفات در فاز مایع نمونههایی از الکترولیتها هستند. همانطور که احتمالا میدانید، الکترولیتها یکی از اجزای اصلی سلولهای الکتروشیمیایی هستند.
رساناهای الکترولیتی در دستگاههای الکترونیکیای استفاده میشوند که در آنها واکنش شیمیایی در یک اتصال فلز - الکترولیت (یعنی بهعنوان مثال یک فلز در اتصال با یک الکترولیک مایع باشد، یا یک فلز در تماس با یک الکترولیت جامد باشد) اثرات مفیدی را به همراه دارد (در ادامه بیشتر متوجه این مطلب خواهید شد).
نمونههایی از کاربردها در برق
تا اینجا پاسخ به سوال الکترولیت چیست داده شد، در این بخش میخواهیم برخی از کاربردهای الکترونیک در برق را مرور نماییم.
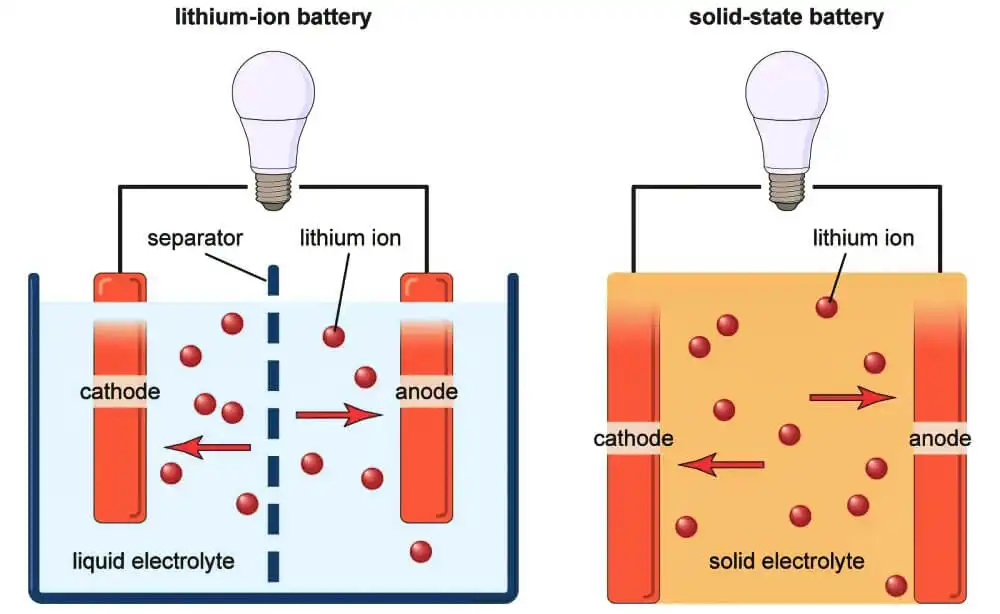
در باتریها: از دو ماده با میل ترکیبی الکترونی متفاوت (electron affinities) بهعنوان الکترود استفاده میشود که در داخل یک الکترولیت قرار دارند. الکترونها از یک الکترود به الکترود دیگر خارج از باتری (منظور در داخل مدار متصل شده به باتری) جریان مییابند، در حالی که در داخل باتری مدار توسط یونهای الکترولیت بسته میشود (الکتریسیته از طریق یونها در داخل الکترولیت جریان مییابد). در اینجا، واکنشهای رخداده در الکترود، انرژی شیمیایی را به انرژی الکتریکی تبدیل میکند (تصویر زیر سمت چپ، در بخش راست نمونه مشابه با الکترولیت حالت جامد نشان داده شده است که در ادامه به آن خواهیم پرداخت).
بنابراین مزیت یک الکترولیت که رسانای یونی است و رسانای الکتریکی (الکترونها) نیست در اینجا مشخص میشود. ما میخواهیم که الکترونها در مداری که به باتری وصل کردهایم جریان داشته باشند و نه در داخل خود باتری. اگر الکترولیت رسانای الکتریکی باشد، مسیری با مقاومت کمتر (از مدار اصلی) برای الکترونها ایجاد میشود تا الکترونها بتوانند از طریق الکترولیت جریان داشته باشند و این یک اتصال کوتاه خواهد بود!
پیل سوختی (fuel cell): یک سلول الکتروشیمیایی است که انرژی شیمیایی یک سوخت (اغلب هیدروژن) و یک عامل اکسیدکننده (اغلب اکسیژن) را از طریق یک جفت واکنش شیمیایی به الکتریسیته تبدیل میکند. سلولهای سوختی نیاز به منبع پیوسته سوخت و اکسیژن (که معمولاً از هوا تامین میشود) برای حفظ واکنش شیمیایی دارند و از این نظر با بیشتر باتریها متفاوت هستند، زیرا در باتری انرژی شیمیایی معمولاً از موادی میآید که از قبل در باتری وجود دارد. پیلهای سوختی تا زمانی که سوخت (اغلب هیدروژن) و اکسیژن تامین میشود میتوانند بهطور مداوم برق تولید کنند. این سلولها یک منبع انرژی پاک و کارآمد هستند که در وسایل نقلیه الکتریکی و ... مورد استفاده قرار میگیرند (نمونه عملی در تصویر زیر).
انواع مختلفی از پیلهای سوختی وجود دارند، اما همه آنها از یک آند، یک کاتد و یک الکترولیت تشکیل شدهاند که به یونها، اغلب یونهای هیدروژن (پروتونها) با بار مثبت اجازه میدهند بین دو طرف پیل سوختی حرکت کنند.

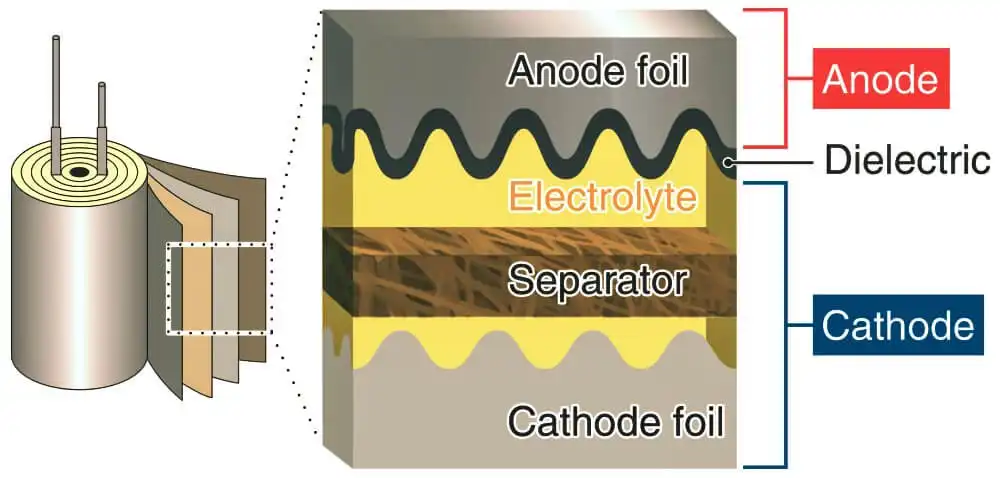
در خازنهای الکترولیتی: آند یا صفحه مثبت خازن از فلزی ساخته شده است که از طریق آندایزاسیون (واکنشی شیمیایی) یک لایه اکسید عایق را تشکیل میدهد. این لایه اکسید بهعنوان دیالکتریک خازن عمل میکند. یک الکترولیت جامد، مایع یا ژل سطح این لایه اکسیدی را میپوشاند و بهعنوان کاتد یا صفحه منفی خازن عمل میکند (تصویر زیر جهت درک لایههای مختلف در خازن الکترولیتی).
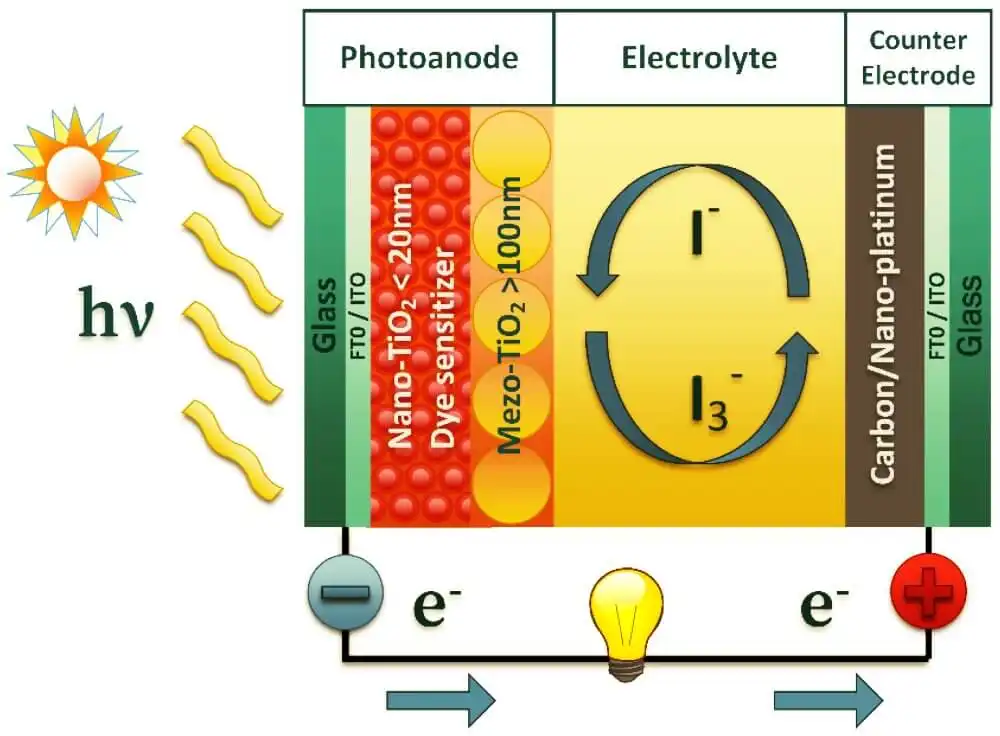
در تبدیل فتوولتائیک: سلولهای خورشیدی نور خورشید را به برق تبدیل میکنند. برخی از سلولهای خورشیدی پیشرفته، مانند سلولهای پروسکایت، از الکترولیتها در طراحی خود برای بهبود انتقال بار و جداسازی الکترونها و حفرههای تولید شده توسط نور خورشید استفاده میکنند. این کار راندمان تبدیل را به حداکثر میرساند و پتانسیل تولید برق از تابش خورشید را افزایش میدهد.
الکترولیتهای حالت جامد
یک الکترولیت حالت جامد (Solid-state electrolyte: SSE) یک رسانای یونی جامد و ماده عایق الکترون است (دقیقا مانند الکترولیت مایع رسانایی را از طریق یونها انجام میدهد و الکترونهای تنها معمولا نمیتوانند از آن عبور کنند) و جزء قابلتوجه باتری حالت جامد است. برای کاربردهای ذخیرهسازی انرژی الکتریکی در جایگزینی الکترولیتهای مایع بهویژه در باتریهای لیتیوم یونی مفید است. مزایای اصلی آن ایمنی کامل، عدم وجود مشکلات مربوط به نشت حلالهای آلی سمی (که در الکترولیت مایع با آن مواجه بودیم)، اشتعالپذیری کم، عدم فراریت، پایداری مکانیکی و حرارتی، خود تخلیهگی کم، چگالی توان قابل دستیابی بالاتر و تعداد دفعات شارژ مجدد بیشتر است.
پسگفتار
در این مطلب تلاش شد کمی بیشتر بدانیم که الکترولیت چیست و با برخی از کاربردهای آن در حوزه برق آشنا شدیم. قطعا کاربردهای متفاوت دیگری نیز از الکترولیت، چه حالت مایع و چه حالت جامد وجود دارند، در صورت آشنایی با آنها تجربه خود را با ما از طریق بخش نظرات در پایین این صفحه به اشتراک گذارید.
ضمنا در صورتی که اکنون کاملا متوجه شدهاید که الکترولیت چیست! و احیانا قصد تهیه خازنهای الکترولیتی آلومینیومی را دارید! میتوانید از دسته مربوطه یعنی خازنهای الکترولیتی آلومینیومی در فروشگاه کهرنیک دیدن نمایید.



جامع و کاربردی مهندس. 👏👌
ممنون پیمان جان.